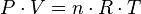Termodinamica
Gases Ideales
Llamado tambien gas perfecto, son aquellos que cumplen con los postulados de la Teoría Cinético Molecular.Ecuación de Estado de los Gases Ideales
Se aplica para una masa de gas finita donde el gas puede estar sujeto a cambios de presion, volumen o temperatura absoluta. (P,V,T)

Procesos Restringidos
Ley de Charles (Proceso Isobárico)
Para una misma masa de gas y a presión constante los cambios de volumen y temperatura absoluta son directamente proporcionales.
Para dos estados:

Ley de Gay- Lussac (Proceso Isócoro)
Para una misma masa de gas y a volumen constante la variación de la presión y temperatura absoluta son directamente propocionales.
Para dos estados:
Ley de Boyle- Mariotte (Proceso Isotérmico)
Para una misma masa de gas y a temperatura constante los cambios de presión y volumen son inversamente proporcional.
Para dos estados:

Proceso Adiabático
Es aquel proceso en el cual no hay transferencia de calor (Q=0) ejemplo: un termo
Ecuacion Universal del los Gases Ideales
En esta ecuación se ven involucradas las propiedades de una gas de masa "m" confinado en un recipiente de volumen "V" a una presión "P" y una temperatura "T".
Donde:
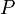 = Presión absoluta
= Presión absoluta = Volumen
= Volumen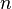 = Moles de gas
= Moles de gas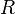 = Constante universal de los gases ideales
= Constante universal de los gases ideales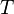 = Temperatura absoluta
= Temperatura absoluta
Se conoce también n=m/M donde:
m: masa del gas
M:masa molecular del gas
Capacidad Calorífica Molar de un Gas Ideal
Un gas puede ser calentado mediante dos procesos:
- A volumen constante
- A presión constante
Capacidad calorífica de un gas ideal
Para un gas ideal se definen dos capacidades caloríficas molares: a volumen constante (CV), y a presión constante (Cp).- CV: es la cantidad de calor que es necesario suministrar a un mol de gas ideal para elevar su temperatura un grado mediante una transformación isócora.
- Cp: es la cantidad de calor que es necesario suministrar a un mol de gas ideal para elevar su temperatura un grado mediante una transformación isóbara.
El valor de ambas capacidades caloríficas puede determinarse con ayuda de la teoría cinética de los gases ideales. Los valores respectivos para gases monoatómicos y diatómicos se encuentran en la siguiente tabla:
Monoatómico Diatómico 




 donde R es la constante universal de los gases ideales, R = 8.31 J/mol K.
donde R es la constante universal de los gases ideales, R = 8.31 J/mol K.- Aplicacion de los gases ideales a la ingeniería:
Tiene demasiadas aplicaciones, el análisis de costos de los combustibles a utilizar, calcular la eficiencia de las maquinas que se utilizan, en los procesos químicos para calcular la energía necesaria para producir y la generada por estas reacciones, calcular el ciclo de trabajo de la maquinaria y equipo.
En fin, la termodinámica es fundamental para la ingeniería industrial
Termodinamica Primera LeyEs aquella región del espacio que se va a seleccionar para analizar los fenómenos que ocurren en el. Un sistema termodinámico puede ser: aislados, cerrados o abiertos- Sistema aislado: es aquél que no intercambia ni materia ni energía con los alrededores.
- Sistema cerrado: es aquél que intercambia energía (calor y trabajo) pero no materia con los alrededores (su masa permanece constante).
- Sistema abierto: es aquél que intercambia energía y materia con los alrededores.
En la siguiente figura se han representado los distintos tipos de sistemas termodinámicos. Primera ley de la termodinámicaTambién conocido como principio de conservación de la energía para la termodinámica, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará. Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Antoine Lavoisier.La ecuación general de la conservación de la energía es la siguiente:
Primera ley de la termodinámicaTambién conocido como principio de conservación de la energía para la termodinámica, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará. Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Antoine Lavoisier.La ecuación general de la conservación de la energía es la siguiente:
Eentra ? Esale = ?EsistemaQue aplicada a la termodinámica teniendo en cuenta el criterio de signos termodinámico, queda de la forma:
\ Q = \Delta U + \ WTermodinamica IIEsta ley experimental axiomática nos permite analizar cualitativa mente los procesos o transformaciones de la energía; esta ley servirá para definir la posibilidad de realización de un proceso termodinámico y sus limitaciones físicas reales.
CONCEPTOS PREVIOSFoco TérmicoAquel sistema de masa inmensamente grande al cual se le puede sustraer o entregar calor, sin que su temperatura experimente notables cambios.
FuenteAquel foco térmico que transfiere calor a la sustancia de trabajo.
SumideroAquel foco térmico en el cual se desfoga el calor previamente utilizando, normalmente recepciona calor.
Maquina TérmicaAquel dispositivo que para su operación continua requiere de una fuente y un sumidero, se encarga de transformar la energía calorífica que se le transfiere, en energía mecánica.Representación de una maquina Térmica
Qa= Wn + Qb
Maquina Refrigeradora (MR)Es obvio por la experiencia, que el calor fluye en dirección de la temperatura decreciente , de medios de alta temperatura a medios de baja temperatura. Este proceso de transferencia sucede en la naturaleza sin requerir ningún dispositivo. Sin embargo, el proceso inverso, no puede ocurrir por si solo.
La transferencia de calor de un medio de baja temperatura a uno de alta temperatura requiere dispositivos especiales llamados refrigeradores.
Los refrigeradores como las maquinas térmicas con dispositivos cíclicos EL fluido de trabajo utilizando en el ciclo de refrigeración se llama refrigerante.Existe otro tipo de dispositivo que transfiere calor de un medio de baja temperatura a uno de alta temperatura es la bomba de calor, mostrada en forma esquemáticaEnunciado de ClausiusSe relaciona con las maquinas térmicas, refrigeradores o bombas de calor.Todos sabemos que el calor no fluye, por si solo, de un medio frio a uno mas caliente. Este enunciado no implica que no se posible construir un dispositivo cíclico que transfiere calor de un medio frió a uno mas caliente. De hecho, esto es precisamente lo que hace un refrigerador domestico común .PROCESO REVERSIBLEEs un proceso idealizado que seria capaz de retornar hasta su estado inicial sin el auxilio del medio anterior, después de una previa evoluciónProceso reversible de un pistón el cual nos dice que debido a la presión del gas, degradar por la misma trayectoria y llega hasta las mismas condiciones.PROCESO IRREVERSIBLESSon aquellas que siguen procesos reales o irreversibles: Son maquinas reales.ENUNCIADO DE CARNOTEs un ciclo de teórico, que lo efectúan las maquinas reversibles con un gas perfecto. Este ciclo denominado de máxima eficiencia esta compuesto por:- 2 procesos
ISOTÉRMICOS REVERSIBLES
- 2 procesos
ADIABATICOS REVERSIBLES
De la figura mostrada:- Expansión
isotérmica reversible (proceso 1-2)
- Expansión
adiabtica ireversible (proceso 2-3 )
- Comprensión
isotermica reversible (proceso 3-4)
- Comprension
adiabatica reversible (proceso 4-1)
- Este ejemplo muestra el orden en que pasan las cosas, al romper un huevo y batirlo se genera un desorden, debido a la 2da ley de la termodinámica no es posible que al batir de nuevo el huevo este se arregle y quedé exactamente igual a como estaba antes de ser roto, Aquel video muestra como se puede ver la segunda ley de la termodinamica.
Aplicaciones de La 2 Ley:· De la Segunda Ley de la Termodinámica se obtiene de facto el concepto de entropía. Las fórmulas de entropía se emplean para infinidad de aplicaciones (si no es que para todo en lo que se requiera obtener modelos energéticos)· La eficiencia y mantenimiento de las cámaras de combustión de los mismos automóviles.· En todas las bombas y conductos de las centrales termoeléctricas.· En los procesos químicos en donde se requieran crear tabletas que puedan transformarse en alguna clase de vapor o gas. En este caso, la segunda ley elimina la posibilidad de que la energía fluya del cuerpo frío al cuerpo caliente y así determina la dirección de la transmisión del calor. La dirección se puede invertir solamente por medio de gasto de un trabajo.